综合新闻
闫玫漪博士等在《mBio》杂志发表结核分枝杆菌新型遗传操作系统的研究
结核病(TB)是威胁人类健康的重要传染病,严重威胁着人类的健康。世界卫生组织(WHO) 估算,全球结核潜伏感染人群约17亿,占全人群的1/4左右; 2019年报告显示2018年全球有1000万新发结核病病例,124万结核病死亡病例。结核病为全球带来严重威胁与沉重负担,新药和更有效疫苗的研发突破迫在眉睫。结核病新药和疫苗的研发依赖于对其病原菌-结核分枝杆菌的生长发育、分化、毒力及耐药等相关基因的分子机制的研究。而有效的遗传操作方法是基因分子机制研究的基础。然而,由于结核分枝杆菌生长缓慢(大约16-24小时复制一代),同时缺乏有效的重组酶,结核分枝杆菌的遗传操作方法一直是其研究中的瓶颈,尤其是对单一功能基因的编辑等。虽然现已有许多基因操作工具成功应用于分枝杆菌中,如自杀质粒、条件复制转运载体、分枝杆菌噬菌体转导、反向遗传选择标记及长片段线性DNA分子,但这些方法存在着费时、低效以及重组效率低等诸多缺点。
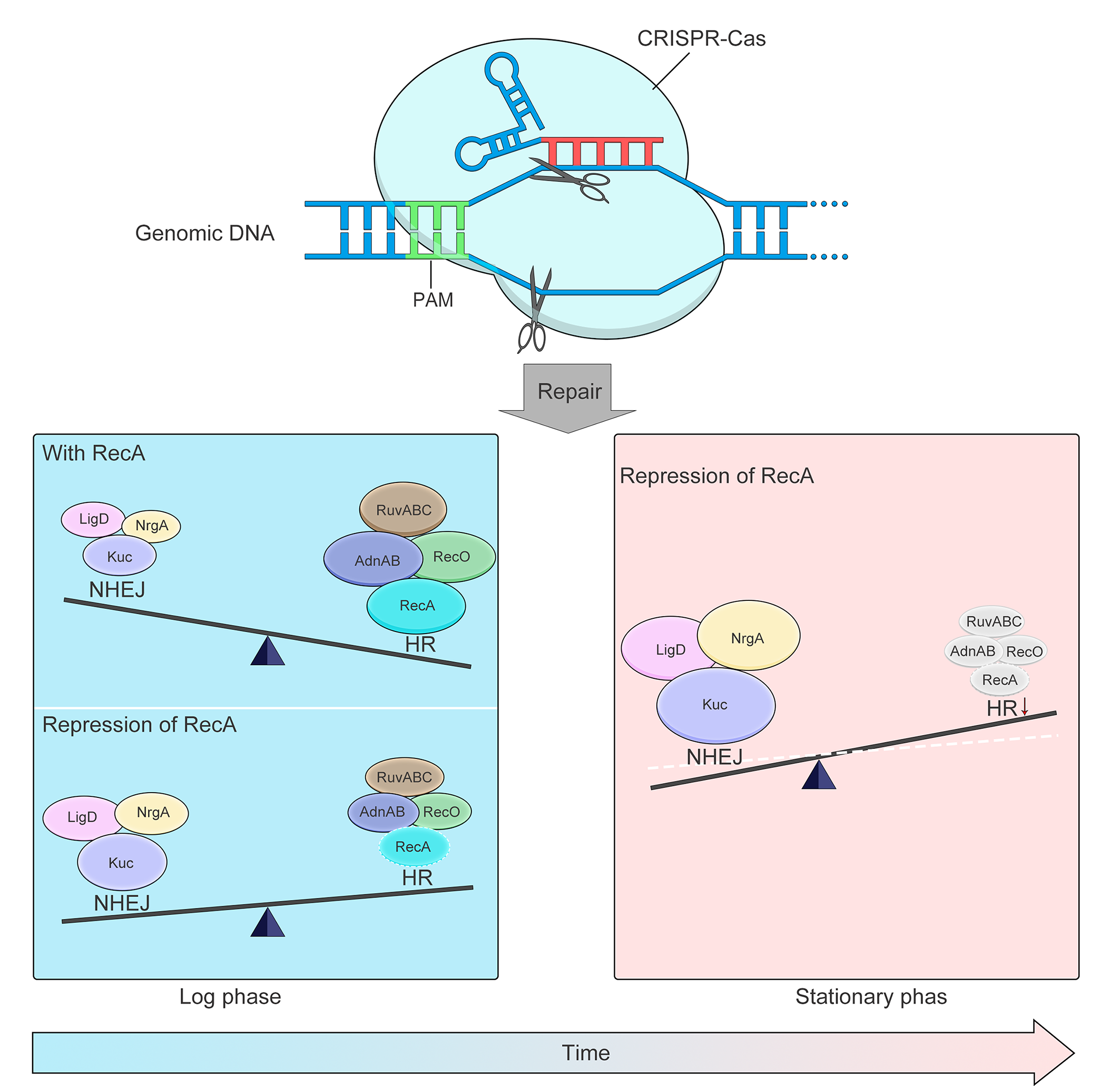
孙义成课题组在mBio杂志发表了题为“A CRISPR-assisted non-homologous end-joining strategy for efficient genome editing in Mycobacterium tuberculosis”的论文,研究报道了将CRISPR-Cas系统与非同源末端连接系统(Non-homologous end-joining,NHEJ)偶联,通过一系列优化实现了在不同种分枝杆菌中进行高效快速的基因编辑。CRISPR-Cas系统能在基因组上匹配位置进行切割形成DNA双链断裂(Double strand break, DSB),DSB主要通过非同源末端连接(Non-homologous end-joining,NHEJ)和同源重组(Homologous recombination, HR)两种途径进行修复。与真核生物修复途径相比,细菌主要通过HR途径对BSB修复。分枝杆菌中存在有内源NHEJ途径,本文通过调控NHEJ与HR的平衡关系:1)高表达NHEJ元件增加NHEJ修复效率;2)抑制RecA介导的HR,进而增加NHEJ修复效率;3)通过诱导启动表达使CRISPR-Cas介导的DSB发生在菌体生长的稳定期这三方面最终实现了在分枝杆菌中进行快速高效地基因删除。与此同时,该系统能够在结核分枝杆菌中进行精确删除以及同时引入多重基因突变,在进行连续敲除时能够大大缩短实验周期。此外,由于该系统高效地编辑效率以及简化的编辑流程,仅通过一次转化即获得到104以上的突变株,因而使得构建突变子库成为可能,为深入研究结核分枝杆菌基因的功能,进而了解结核分枝杆菌耐药相关机制提供可靠的技术支持。该研究工作得到了中国医学科学院医学与健康科技创新工程等项目的资助。