综合新闻
刘晓满、魏亮等在《Science Signaling》发表关于SARS-CoV-2 virus诱导细胞融合激活cGAS-STING通路的研究成果
SARS-CoV-2病毒感染导致了新冠相关疾病(COVID-19)世界范围的大流行,重症COVID-19常伴随大量的炎症因子产生和严重的肺损伤。I型干扰素(IFN)系统在其中发挥重要作用,一方面对抗病毒免疫至关重要,另一方面也可能导致过度炎症和免疫病理。
已有研究发现在重症COVID-19患者肺部存在大量融合的肺泡细胞。此外,在SARS-CoV-2感染的动物肺部和细胞模型中,都观察到细胞-细胞融合的现象。提示SARS-CoV-2诱导的细胞-细胞融合可能在病毒感染诱导的免疫应答中发挥作用,但其具体机制并不清楚。
作者首先利用表达SARS-CoV-2 Spike (S) 蛋白的供体细胞与A549-ACE2靶细胞共培养诱导细胞-细胞融合,模拟SARS-CoV-2 病毒感染诱导多胞体形成的过程。利用RNA测序技术分析融合细胞和非融合细胞的基因表达差异,并对上调的73/79个基因进行聚类分析发现,差异基因主要集中在抗病毒应答、干扰素应答、细胞因子应答通路,提示多核体细胞中天然免疫应答通路活化。在分析不同多核体细胞的基因表达差异时,发现HEK293T-ACE2形成的多核体细胞中IFN通路没有活化。已有研究发现在HEK293T细胞中cGAS-STING通路缺失,推测是否cGAS-STING通路在多核体细胞产生IFN中发挥作用。通过基因敲除和过表达cGAS/STING,证实cGAS分子通过感知融合细胞中释放的微核,产生2’ 3’-cGAMP激活STING,进而促进I型干扰素应答(如图)。与VSV病毒感染相比,VSV-SARS-CoV-2-S病毒感染诱导细胞形成多核体,并产生核损伤,释放微核,促使cGAS识别细胞质中的微核,促进IFN产生。由于此类I型IFN应答是感染细胞中大量合成的S蛋白与相邻细胞表面的ACE2受体结合诱发细胞-细胞融合,进而导致核损伤释放的微核被cGAS识别导致的,发生于SARS-CoV-2感染晚期。不同于病毒感染早期,进入的病毒基因组RNA被TLR3, MDA5和RIG-I等模式识别受体识别所诱导产生的IFN,病毒感染晚期产生的IFN被认为加剧了炎症反应和病理损伤。这也与Domizio(Nature, 2022)和Neufeldt(Commun Biol, 2022)分别在近期发表的两篇研究结果一致,提示SARS-CoV-2感染导致细胞融合激活cGAS-STING是COVID-19中病理性I型IFN反应的主要驱动因素。该研究发现S蛋白诱导的细胞-细胞融合激活cGAS-STING通路促进I型IFN反应,推测其加重COVID19免疫病理,提示蛋白酶抑制剂、中和抗体和小分子药物可能通过靶向抑制细胞融合在重症保护中发挥作用。
该成果4月12日在《Science Signaling》杂志发表,题目为“SARS-CoV-2 spike protein–induced cell fusion activates the cGAS-STING pathway and the interferon response”,被选为当期杂志封面,并入选当期science杂志的“research highlight”。
我所博士后刘晓满、硕士研究生魏亮为论文共同第一作者,郭斐研究员、加拿大麦吉尔大学梁臣教授和中国医学科学院生物技术研究所岑山教授为论文共同通讯作者。该研究得到国家自然科学基金、国家重点研发计划和中国医学科学院医学与健康科技创新工程等项目的支持。
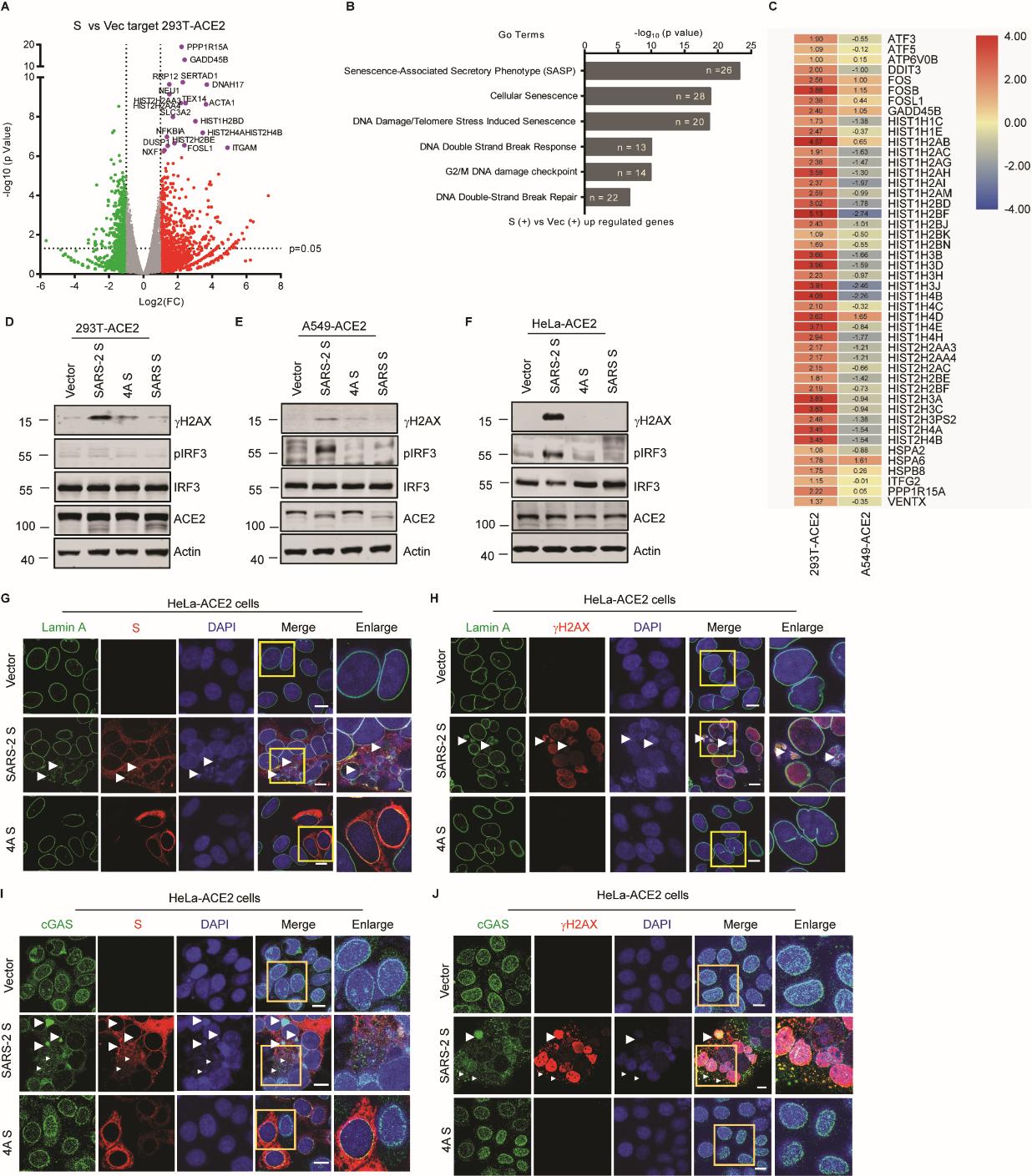
图. 表达S蛋白的融合细胞发生核损伤,并释放微核被cGAS分子识别
(图源:Liu XM, et al., Sic signaling, 2022)
