综合新闻
硕士研究生宿扬等在《Journal of Virology》发表关于HIV融合抑制剂耐药机制的研究论文
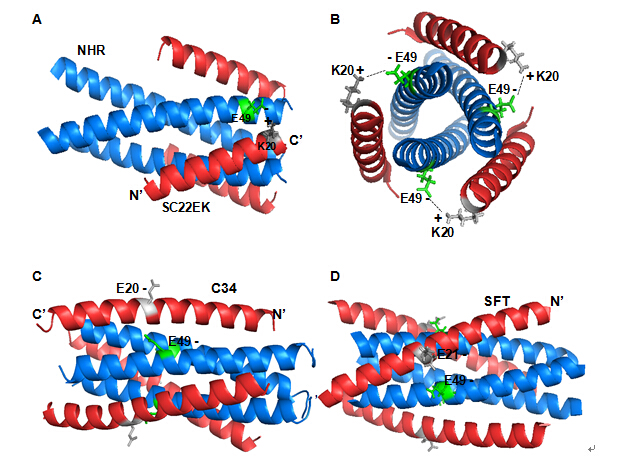
恩夫韦肽(T20)是目前唯一临床应用的HIV膜融合抑制剂,但该药极易产生耐药性,研发新一代阻断病毒融合过程的艾滋病治疗药物成为当前的热。HIV融合蛋白gp41所具有的疏水深穴(deep hydrophobic pocket)在序列和结构上高度保守,一直被认为是理想的药物靶点,但针对该靶点的高效抑制剂却少有报道。何玉先课题组根据gp41结构与功能的新发现,设计了多个以疏水深穴为靶向的抗病毒短肽(FASEB J,2013;AIDS,2015)。该文通过采用突变分析,发现位于N端和C端螺旋区的两个点突变(E49K和N126K)不但介导短肽抑制剂的高度耐药,而且对恩夫韦肽和临床试验中的西夫韦肽(SFT)亦产生交叉耐药。随后基于病毒学、分子生物学和生物物理的实验观察,提出了HIV膜融合抑制剂耐药产生的三个机制:(1)靶点结合能力的下降;(2)病毒自身六螺旋稳定性的增加;(3)包膜蛋白的功能受损。该研究对gp41的结构与功能以及新型病毒融合抑制剂的设计都具有重要的科学意义和应用价值。