综合新闻
硕士研究生宿扬等在《Journal of Virology》再次发表关于HIV膜融合抑制剂耐药机制的研究结果
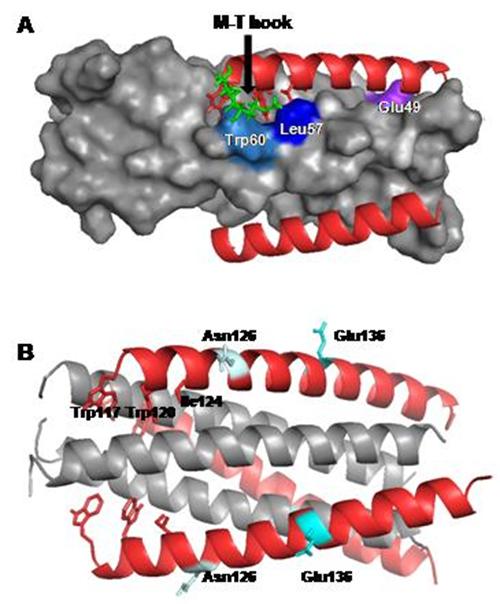
膜融合是一极其重要的生物学现象,比如受精卵的形成和细胞内的囊泡运输等;许多重要病毒也是通过膜融合感染宿主细胞,该过程中涉及的组分被认为具备成为药物靶标的潜能。T20(恩夫韦肽)是目前唯一临床应用的针对HIV-1膜融合的药物,但该药具有价格昂贵、极易诱导耐药等缺点,极大地限制了它的广泛使用。何玉先课题组多年来聚焦于病毒膜融合机制和抑制剂的研究,在多方面取得研究进展。基于M-T钩子结构的发现,他们前期设计了以gp41融合蛋白疏水深穴为靶向的抗病毒短肽MTSC22和HP23(FASEB J,2013;AIDS,2015),并对模板多肽SC22EK的耐药机制进行了探讨(J Virol, 2015a)。本研究聚焦于新型抑制剂MTSC22的耐药机制研究,该多肽含有M-T钩子结构,对疏水深穴具有极强的结合能力。通过定点突变发现,位于N端和C端螺旋区的多个位点与MTSC22耐药相关,尤其位于疏水深穴的L57R突变和位于C端螺旋区E136G突变是以前尚未发现的耐药位点。该论文还结合多种技术,对这些位点如何介导耐药的分子机制进行了深入分析。上述研究对gp41的结构与功能以及新型抗病毒药物的设计都具有重要的科学意义和应用价值。