综合新闻
贾雪博士等在《The Journal of Immunology》杂志在线发表关于RNF125调控TRIM14抗病毒活性机制的研究
天然免疫系统是机体抗病毒感染的第一道防线。在抗病毒天然免疫反应过程中,免疫分子被活化并通过信号转导途径激活干扰素和炎症因子的表达,进而对入侵的病原体进行清除。然而,过量的炎症因子会造成机体自身损害,因此参与抗病毒天然免疫反应的免疫分子的活性必须受到严格的调控。前期王健伟研究员课题组鉴定出线粒体接头分子TRIM14蛋白通过K365泛素链招募NEMO至线粒体促进MAVS信号复合物的组装,正向调控抗病毒天然免疫反应。因此,TRIM14是重要的抗病毒免疫分子(Zhou et al. PNAS, 2014)。但是,病毒被清除后,TRIM14如何被调控尚不清楚。
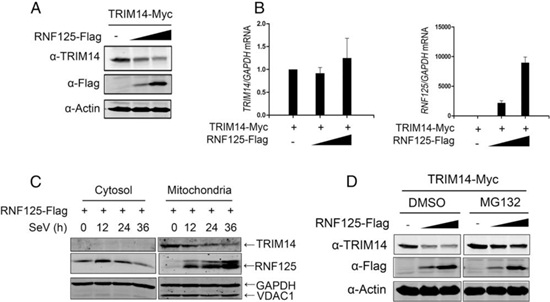
贾雪博士等根据TRIM14在抗病毒反应中发生泛素化的特点,对抗病毒反应信号通路中常见的泛素连接酶进行筛选,鉴定出E3泛素连接酶RNF125能够显著促进TRIM14泛素化,并利用体外蛋白酶促反应实验证实RNF125是TRIM14的E3泛素连接酶。过表达RNF125能抑制TRIM14抗病毒功能,而敲低RNF125则促进TRIM14的抗病毒功能,提示RNF125负调控TRIM14的抗病毒活性。进一步研究发现TRIM14发生RNF125催化的K48泛素化, 并通过泛素-蛋白酶体途径降解。另外,干扰素处理敲除RNF125的小鼠成纤维细胞(MEF)后,TRIM14蛋白水平持续增加,而野生型MEF细胞中TRIM14蛋白水平在后期下降,进一步证明了RNF125对TRIM14的调控功能。该研究揭示了TRIM14的负调控机制,为阐明天然免疫反应的平衡机制提供了新的依据。